ในบทที่ 13 "" จากหลักสูตร " เคมีสำหรับหุ่น» พิจารณาว่าเหตุใดจึงต้องใช้สมการเคมี มาเรียนรู้วิธีทำให้ปฏิกิริยาเคมีเท่ากันโดยจัดเรียงสัมประสิทธิ์ให้ถูกต้อง บทเรียนนี้จะทำให้คุณต้องรู้เคมีพื้นฐานจากบทเรียนก่อนหน้า อย่าลืมอ่านเกี่ยวกับการวิเคราะห์องค์ประกอบเพื่อดูสูตรเชิงประจักษ์และการวิเคราะห์ทางเคมีในเชิงลึก
อันเป็นผลมาจากปฏิกิริยาการเผาไหม้ของมีเทน CH 4 ในออกซิเจน O 2 จะเกิดคาร์บอนไดออกไซด์ CO 2 และน้ำ H 2 O ปฏิกิริยานี้สามารถอธิบายได้ สมการทางเคมี:
- CH 4 + O 2 → CO 2 + H 2 O (1)
เรามาลองดึงข้อมูลจากสมการทางเคมีมากกว่าแค่ข้อบ่งชี้กันดีกว่า ผลิตภัณฑ์และรีเอเจนต์ปฏิกิริยา สมการทางเคมี (1) ไม่สมบูรณ์ ดังนั้นจึงไม่ได้ให้ข้อมูลใดๆ เกี่ยวกับจำนวนโมเลกุล O 2 ที่ใช้ต่อโมเลกุล 1 CH 4 และผลลัพธ์ที่ได้คือจำนวนโมเลกุล CO 2 และ H2 O แต่ถ้าเราเขียนค่าสัมประสิทธิ์ตัวเลขไว้หน้าสูตรโมเลกุลที่เกี่ยวข้องซึ่งระบุจำนวนโมเลกุลของแต่ละประเภทที่มีส่วนร่วมในปฏิกิริยา เราก็จะได้ สมการทางเคมีที่สมบูรณ์ปฏิกิริยา
เพื่อให้องค์ประกอบของสมการเคมีสมบูรณ์ (1) คุณต้องจำกฎง่ายๆ กฎข้อหนึ่ง: ด้านซ้ายและด้านขวาของสมการจะต้องมีจำนวนอะตอมแต่ละประเภทเท่ากัน เนื่องจากในระหว่างปฏิกิริยาเคมีจะไม่มีอะตอมใหม่เกิดขึ้น สิ่งที่สร้างขึ้นและสิ่งที่มีอยู่ไม่ถูกทำลาย กฎนี้เป็นไปตามกฎการอนุรักษ์มวล ซึ่งเราได้พูดคุยไปแล้วในตอนต้นของบท
จำเป็นเพื่อให้ได้ค่าที่สมบูรณ์จากสมการเคมีอย่างง่าย มาดูสมการที่แท้จริงของปฏิกิริยา (1) กันก่อน ลองดูสมการทางเคมีอีกครั้ง ที่อะตอมและโมเลกุลทางด้านขวาและด้านซ้าย เห็นได้ง่ายว่าปฏิกิริยาเกี่ยวข้องกับอะตอมสามประเภท ได้แก่ คาร์บอน C ไฮโดรเจน H และออกซิเจน O ลองนับและเปรียบเทียบจำนวนอะตอมของแต่ละประเภททางด้านขวาและด้านซ้ายของสมการทางเคมี

เริ่มจากคาร์บอนกันก่อน ทางด้านซ้าย อะตอม C หนึ่งอะตอมเป็นส่วนหนึ่งของโมเลกุล CH 4 และทางด้านขวา อะตอม C หนึ่งอะตอมเป็นส่วนหนึ่งของ CO 2 ดังนั้นทางซ้ายและขวาจำนวนอะตอมของคาร์บอนเท่ากัน ดังนั้นเราจึงปล่อยมันไว้ตามลำพัง แต่เพื่อความชัดเจน ลองใส่สัมประสิทธิ์ 1 หน้าโมเลกุลที่มีคาร์บอน แม้ว่าจะไม่จำเป็นก็ตาม
- 1CH 4 + โอ 2 → 1CO 2 + H 2 โอ (2)
จากนั้นเราก็ไปนับอะตอมไฮโดรเจน H กันต่อ ทางด้านซ้ายมีอะตอม H 4 อะตอม (ในแง่ปริมาณ H 4 = 4H) ในโมเลกุล CH 4 และทางด้านขวามีอะตอม H เพียง 2 อะตอมใน โมเลกุล H 2 O ซึ่งน้อยกว่าทางด้านซ้ายของสมการทางเคมี (2) สองเท่า มาเท่าเทียมกันกันเถอะ! ให้ใส่สัมประสิทธิ์ 2 หน้าโมเลกุล H 2 O ตอนนี้เราจะมีไฮโดรเจน H 4 โมเลกุลทั้งในสารตั้งต้นและผลิตภัณฑ์:
- 1CH 4 + โอ 2 → 1CO 2 + 2H 2 โอ (3)
โปรดทราบว่าค่าสัมประสิทธิ์ 2 ซึ่งเราเขียนไว้หน้าโมเลกุลน้ำ H 2 O เพื่อทำให้ไฮโดรเจน H เท่ากันนั้นเพิ่มขึ้น 2 เท่าของอะตอมทั้งหมดที่รวมอยู่ในองค์ประกอบนั่นคือ 2H 2 O หมายถึง 4H และ 2O โอเค ดูเหมือนเราจะแยกเรื่องนี้ออกแล้ว สิ่งที่เหลืออยู่คือการนับและเปรียบเทียบจำนวนอะตอมออกซิเจน O ในสมการทางเคมี (3) มันดึงดูดสายตาคุณทันทีว่ามีอะตอม O ทางด้านซ้ายน้อยกว่าทางด้านขวาถึง 2 เท่า ตอนนี้คุณรู้วิธีสมดุลสมการเคมีด้วยตัวเองแล้ว ดังนั้นฉันจะเขียนผลลัพธ์สุดท้ายทันที:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O หรือ CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
อย่างที่คุณเห็น การทำปฏิกิริยาเคมีให้เท่ากันไม่ใช่เรื่องยุ่งยาก และสิ่งสำคัญในที่นี้ไม่ใช่เคมี แต่เป็นคณิตศาสตร์ สมการ (4) เรียกว่า สมการที่สมบูรณ์ปฏิกิริยาเคมี เนื่องจากเป็นไปตามกฎการอนุรักษ์มวลเช่น จำนวนอะตอมของแต่ละประเภทที่เข้าสู่ปฏิกิริยาจะตรงกับจำนวนอะตอมประเภทนี้เมื่อปฏิกิริยาเสร็จสิ้น แต่ละด้านของสมการทางเคมีที่สมบูรณ์นี้ประกอบด้วยคาร์บอน 1 อะตอม ไฮโดรเจน 4 อะตอม และออกซิเจน 4 อะตอม อย่างไรก็ตาม ควรทำความเข้าใจประเด็นสำคัญสองสามข้อ: ปฏิกิริยาเคมีเป็นลำดับที่ซับซ้อนของขั้นตอนกลางแต่ละขั้น ดังนั้น สมการ (4) จึงไม่สามารถตีความในแง่ที่ว่าโมเลกุลมีเทน 1 โมเลกุลจะต้องชนกับออกซิเจน 2 ตัวพร้อมกัน โมเลกุล กระบวนการที่เกิดขึ้นระหว่างการก่อตัวของผลิตภัณฑ์ที่ทำปฏิกิริยานั้นซับซ้อนกว่ามาก จุดที่สอง: สมการที่สมบูรณ์ของปฏิกิริยาไม่ได้บอกอะไรเราเกี่ยวกับกลไกระดับโมเลกุลของมัน กล่าวคือเกี่ยวกับลำดับเหตุการณ์ที่เกิดขึ้นในระดับโมเลกุลระหว่างการเกิดขึ้น
ค่าสัมประสิทธิ์ในสมการปฏิกิริยาเคมี
อีกตัวอย่างที่ชัดเจนของวิธีการจัดเรียงอย่างถูกต้อง อัตราต่อรองในสมการปฏิกิริยาเคมี: Trinitrotoluene (TNT) C 7 H 5 N 3 O 6 รวมตัวกับออกซิเจนอย่างแรงจนเกิดเป็น H 2 O, CO 2 และ N 2 ให้เราเขียนสมการปฏิกิริยาที่เราจะทำให้มันเท่ากัน:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
การสร้างสมการที่สมบูรณ์โดยใช้โมเลกุล TNT สองตัวนั้นง่ายกว่า เนื่องจากด้านซ้ายมีจำนวนอะตอมของไฮโดรเจนและไนโตรเจนเป็นเลขคี่ และด้านขวาเป็นเลขคู่:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
เป็นที่ชัดเจนว่าคาร์บอน 14 อะตอม ไฮโดรเจน 10 อะตอม และไนโตรเจน 6 อะตอม จะต้องกลายเป็นคาร์บอนไดออกไซด์ 14 โมเลกุล น้ำ 5 โมเลกุล และไนโตรเจน 3 โมเลกุล:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
ตอนนี้ทั้งสองส่วนมีจำนวนอะตอมเท่ากันยกเว้นออกซิเจน จากอะตอมออกซิเจน 33 อะตอมที่อยู่ทางด้านขวาของสมการ มี 12 อะตอมมาจากโมเลกุล TNT ดั้งเดิม 2 อะตอม และอีก 21 อะตอมที่เหลือจะต้องมาจาก 10.5 O 2 โมเลกุล ดังนั้นสมการเคมีที่สมบูรณ์จะมีลักษณะดังนี้:
- 2C 7 H 5 N 3 O 6 + 10.5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
คุณสามารถคูณทั้งสองข้างด้วย 2 และกำจัดสัมประสิทธิ์ที่ไม่ใช่จำนวนเต็ม 10.5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
แต่คุณไม่จำเป็นต้องทำเช่นนี้ เนื่องจากสัมประสิทธิ์ทั้งหมดของสมการไม่จำเป็นต้องเป็นจำนวนเต็ม การสร้างสมการตามโมเลกุลทีเอ็นทีหนึ่งโมเลกุลจะยิ่งถูกต้องมากขึ้น:
- C 7 H 5 N 3 O 6 + 5.25O 2 → 7CO 2 + 2.5H 2 O + 1.5N 2 (10)
สมการเคมีที่สมบูรณ์ (9) มีข้อมูลมากมาย ก่อนอื่นมันบ่งบอกถึงสารตั้งต้น - รีเอเจนต์, และ สินค้าปฏิกิริยา นอกจากนี้ยังแสดงให้เห็นว่าในระหว่างการทำปฏิกิริยาอะตอมทั้งหมดของแต่ละประเภทจะถูกเก็บรักษาแยกกัน หากเราคูณทั้งสองข้างของสมการ (9) ด้วยเลขอาโวกาโดร N A = 6.022 10 23 เราสามารถระบุได้ว่าทีเอ็นที 4 โมลทำปฏิกิริยากับ O 2 21 โมล ทำให้เกิด CO 2 28 โมล H 2 O 10 โมล และ 6 โมลของ N 2
มีเคล็ดลับอีกอย่างหนึ่ง เมื่อใช้ตารางธาตุ เราจะหามวลโมเลกุลของสารเหล่านี้ทั้งหมด:
- C 7 H 5 N 3 O 6 = 227.13 กรัม/โมล
- O2 = 31.999 กรัม/โมล
- CO2 = 44.010 กรัม/โมล
- H2O = 18.015 กรัม/โมล
- N2 = 28.013 กรัม/โมล
ตอนนี้สมการที่ 9 ยังระบุด้วยว่า 4 227.13 กรัม = 908.52 กรัมของ TNT ต้องการออกซิเจน 21 31.999 กรัม = 671.98 กรัมเพื่อทำให้ปฏิกิริยาสมบูรณ์ และผลที่ได้คือ 28 44.010 กรัม = 1232.3 กรัมของ CO 2 เกิดขึ้น 10·18.015 กรัม = 180.15 ก. H2O และ 6·28.013 ก. = 168.08 ก. N2 ตรวจสอบว่ากฎการอนุรักษ์มวลเป็นไปตามปฏิกิริยานี้หรือไม่:
| รีเอเจนต์ | สินค้า | |
| 908.52 ก. ทีเอ็นที | คาร์บอนไดออกไซด์ 1232.3 กรัม | |
| คาร์บอนไดออกไซด์ 671.98 กรัม | 180.15 ก. เอช2โอ | |
| 168.08 ก. N2 | ||
| ทั้งหมด | 1580.5 ก | 1580.5 ก |
แต่แต่ละโมเลกุลไม่จำเป็นต้องมีส่วนร่วมในปฏิกิริยาเคมีเสมอไป ตัวอย่างเช่น ปฏิกิริยาของหินปูน CaCO3 และกรดไฮโดรคลอริก HCl เพื่อสร้างสารละลายแคลเซียมคลอไรด์ CaCl2 และ CO2 คาร์บอนไดออกไซด์:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
สมการทางเคมี (11) อธิบายปฏิกิริยาของแคลเซียมคาร์บอเนต CaCO 3 (หินปูน) และกรดไฮโดรคลอริก HCl เพื่อสร้างสารละลายในน้ำของแคลเซียมคลอไรด์ CaCl 2 และคาร์บอนไดออกไซด์ CO 2 สมการนี้เสร็จสมบูรณ์แล้ว เนื่องจากจำนวนอะตอมของแต่ละประเภททางซ้ายและขวาเท่ากัน
ความหมายของสมการนี้คือ ระดับมหภาค (ฟันกราม)เป็นดังนี้: CaCO 3 1 โมลหรือ 100.09 กรัม ต้องใช้ HCl 2 โมล หรือ 72.92 กรัม เพื่อให้ปฏิกิริยาสมบูรณ์ ส่งผลให้ CaCl 2 1 โมล (110.99 กรัม/โมล), CO 2 (44.01 กรัม/โมล) และ H 2 O (18.02 ก./โมล) จากข้อมูลตัวเลขเหล่านี้ ง่ายต่อการตรวจสอบว่ากฎการอนุรักษ์มวลเป็นไปตามปฏิกิริยานี้
การตีความสมการ (11) บน ระดับจุลทรรศน์ (โมเลกุล)ไม่ชัดเจนนัก เนื่องจากแคลเซียมคาร์บอเนตเป็นเกลือ ไม่ใช่สารประกอบโมเลกุล ดังนั้นสมการทางเคมี (11) จึงไม่สามารถเข้าใจได้ในแง่ที่ว่าแคลเซียมคาร์บอเนต CaCO 3 1 โมเลกุลทำปฏิกิริยากับ HCl 2 โมเลกุล ยิ่งไปกว่านั้น โมเลกุล HCl ในสารละลายโดยทั่วไปจะแยกตัว (แตกตัว) เป็น H + และ Cl - ไอออน ดังนั้นคำอธิบายที่ถูกต้องมากขึ้นเกี่ยวกับสิ่งที่เกิดขึ้นในปฏิกิริยานี้ในระดับโมเลกุลจึงได้รับจากสมการ:
- CaCO 3 (โซล.) + 2H + (aq.) → Ca 2+ (aq.) + CO 2 (ก.) + H 2 O (ล.) (12)
ในที่นี้ สถานะทางกายภาพของอนุภาคแต่ละประเภทจะแสดงโดยย่อในวงเล็บ ( โทรทัศน์- แข็ง, อค.- ไอออนไฮเดรตในสารละลายที่เป็นน้ำ ช.- แก๊ส และ.- ของเหลว).
สมการ (12) แสดงให้เห็นว่า CaCO 3 ที่เป็นของแข็งทำปฏิกิริยากับไอออน H + ไฮเดรต 2 ไอออน ทำให้เกิดไอออนบวก Ca 2+, CO 2 และ H 2 O สมการ (12) เช่นเดียวกับสมการทางเคมีอื่นๆ ที่ไม่ได้ให้แนวคิดของ ปฏิกิริยาของกลไกระดับโมเลกุลและไม่สะดวกในการนับปริมาณสาร แต่ให้คำอธิบายที่ดีกว่าถึงสิ่งที่เกิดขึ้นในระดับจุลภาค
เสริมความรู้ของคุณในการเขียนสมการเคมีโดยการทำงานผ่านตัวอย่างพร้อมวิธีแก้ปัญหาด้วยตนเอง:
ฉันหวังว่าจากบทที่ 13" การเขียนสมการเคมี“คุณได้เรียนรู้สิ่งใหม่ๆ สำหรับตัวคุณเอง หากคุณมีคำถามใด ๆ เขียนไว้ในความคิดเห็น
ล  การใส่สัมประสิทธิ์ในสมการเคมีเป็นเรื่องง่ายหรือไม่?
การใส่สัมประสิทธิ์ในสมการเคมีเป็นเรื่องง่ายหรือไม่?
ลูกๆ ของฉันจึงโตมากับวิชาเคมี (ฉันเป็นครูประจำชั้นเกรด B ที่ 8) เด็กส่วนใหญ่มักสอนวิชาเคมีในบทเรียนแรก แต่ในวันพฤหัสบดี ฉันไม่มีบทเรียนแรก และฉันขอไปที่บทเรียนของ Valentina Ivanovna เพื่อ "ดูเด็ก ๆ" และตรวจสอบสมุดบันทึก หัวข้อนี้ทำให้ฉันทึ่ง ที่โรงเรียน ฉันชอบวิชาเคมี และไม่ได้เช็คไดอารี่เลย ฉันเชื่อมั่นอีกครั้งว่านักเรียนส่วนใหญ่มักประสบปัญหาเนื่องจากไม่เห็นความเชื่อมโยงแบบสหวิทยาการ ในบทเรียนเคมีนี้ นักเรียนจะต้องสร้างสมการทางเคมีโดยพิจารณาจากความจุของสารเคมี และนักเรียนหลายคนประสบปัญหาในการหาค่าสัมประสิทธิ์เชิงตัวเลข Valentina Ivanovna และฉันเรียนวิชาเคมีครั้งต่อไปด้วยกันในวันเสาร์
แบบฝึกหัดที่ 1
เขียนประโยคต่อไปนี้เป็นสมการทางเคมี:
A) “เมื่อเผาแคลเซียมคาร์บอเนต จะเกิดแคลเซียมออกไซด์และคาร์บอนมอนอกไซด์ (IV)”; b) “เมื่อฟอสฟอรัส (V) ออกไซด์ทำปฏิกิริยากับน้ำ จะได้กรดฟอสฟอริก”
สารละลาย:
A) CaCO 3 = CaO + CO 2 - ปฏิกิริยาคือการดูดความร้อน งานนี้ไม่มีปัญหาเนื่องจากไม่จำเป็นต้องค้นหาค่าสัมประสิทธิ์ตัวเลข ในตอนแรก ด้านซ้ายและด้านขวาของสมการประกอบด้วยอะตอมแคลเซียม 1 อะตอม คาร์บอน 1 อะตอม และออกซิเจน 3 อะตอม
B) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - ปฏิกิริยาคายความร้อน มีปัญหากับสมการที่สองหากไม่มีค่าสัมประสิทธิ์ตัวเลขความเท่าเทียมกันที่ถูกต้องไม่ได้ผล: P 2 O 5 + H 2 O → H 3 PO 4 . แน่นอนว่าหากต้องการสร้างความเท่าเทียมกันให้ถูกต้อง คุณต้องเลือกค่าสัมประสิทธิ์ตัวเลข หากคุณเลือกคุณสามารถเริ่มต้นด้วยฟอสฟอรัส: มีสองอะตอมทางด้านซ้ายและอีกอะตอมอยู่ทางขวาดังนั้นก่อนสูตรของกรดไนตริกเราจึงใส่ตัวประกอบตัวเลขเท่ากับสองแล้วเราจะได้: P 2 O 5 + H 2 O → 2H 3 PO 4 . แต่ตอนนี้ยังคงต้องทำให้จำนวนอะตอมออกซิเจนและไฮโดรเจนเท่ากัน: มีไฮโดรเจนสองอะตอมทางด้านซ้ายและหกอะตอมทางด้านขวา ดังนั้นก่อนสูตรน้ำเราจึงใส่สัมประสิทธิ์ตัวเลขเท่ากับสามแล้วเราจะได้: P 2 O 5 + 3H 2 O → 2H 3 PO 4 ตอนนี้ง่ายต่อการตรวจสอบว่าในแต่ละส่วนของสมการนั้นมีอะตอมฟอสฟอรัส อะตอมไฮโดรเจน และอะตอมออกซิเจนในปริมาณเท่ากัน ดังนั้นเราจึงได้สมการที่ถูกต้องของปฏิกิริยาเคมี: P 2 O 5 + 3H 2 O = 2H 3 ป.4.
วิธีที่สอง: พีชคณิตสมมติว่าเราใส่ค่าสัมประสิทธิ์สามค่าลงในสมการ ก ข ค เพื่อให้ได้สมการที่ถูกต้องของปฏิกิริยาเคมี: ก P2O5+ วี น้ำ2O= กับ H3PO4 เนื่องจากสมการนี้ใช้อะตอมสามประเภท เราจะสร้างระบบสมการเชิงเส้นสามตัวโดยไม่ทราบค่าสามค่า ก, คและ กับ .
สารที่ใช้ในปฏิกิริยาเคมี: P – ฟอสฟอรัส; O 2 – ออกซิเจน; P 2 O 5 – ฟอสฟอรัส (V) ออกไซด์
B) เฟ 2 (SO 4) 3 + KOH → เฟ (OH) 3 + K 2 SO 4
สารที่ใช้ในปฏิกิริยาเคมี: Fe 2 (SO 4) 3 – เหล็ก (III) ซัลเฟต; KOH – โพแทสเซียมไฮดรอกไซด์; Fe(OH) 3 – เหล็ก (III) ไฮดรอกไซด์; K 2 SO 4 – โพแทสเซียมซัลเฟต
D) CuOH → Cu 2 O + H 2 O
สารละลาย: 2CuOH = Cu 2 O + H 2 O ปัญหาในการกำหนดค่าสัมประสิทธิ์ตัวเลขได้รับการแก้ไขโดยการเขียนระบบสมการ: 
สารที่ใช้ในปฏิกิริยาเคมี: CuOH – คอปเปอร์ (I) ไฮดรอกไซด์; Cu 2 O – ทองแดง (I) ออกไซด์; H 2 O – น้ำ
ง) CS 2 + O 2 → CO 2 + SO 2
สารละลาย: ซีเอส 2 + 3O 2 = CO 2 + 2SO 2 เราแก้ไขโดยการเลือกสัมประสิทธิ์: เราทำให้จำนวนอะตอมกำมะถันเท่ากัน (2); ทำให้จำนวนอะตอมออกซิเจนเท่ากัน (3)
สารที่ใช้ในปฏิกิริยาเคมี: CS 2 – ซัลเฟอร์ (IV) ซัลไฟด์; โอ 2 –
สารที่ใช้ในปฏิกิริยาเคมี: FeS 2 – ไพไรต์; O 2 – ออกซิเจน; Fe 2 O 3 – เหล็ก (III) ออกไซด์; SO 2 - ซัลเฟอร์ออกไซด์ (IV)
แบบฝึกหัดที่ 3
(เสนอวิธีแก้ปัญหาเป็นงานแยกต่างหาก)
เงื่อนไข:
เขียนสมการปฏิกิริยาเคมีตามรูปแบบต่อไปนี้:
A) กรดฟอสฟอริก + โซเดียมไฮดรอกไซด์ → โซเดียมฟอสเฟต + น้ำ
B) โซเดียมออกไซด์ + น้ำ → โซเดียมไฮดรอกไซด์;
B) เหล็ก (II) ออกไซด์ + อลูมิเนียม → อลูมิเนียมออกไซด์ + เหล็ก
D) คอปเปอร์ (II) ไฮดรอกไซด์ → คอปเปอร์ (II) ออกไซด์ + น้ำ
คำตอบ:
ก) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O;
B) นา 2 O + H 2 O = 2NaOH;
B) 3FeO + 2Al = อัล 2 O 3 + 3Fe;
ง) Cu(OH) 2 = CuO + H 2 O.
ใน 10 นาที นักเรียน 85% ทำงานเสร็จ "ดีเยี่ยม" ซึ่งทำให้ Valentina Ivanovna ประหลาดใจ
มีหลายวิธีในการกำหนดค่าสัมประสิทธิ์ในสมการของปฏิกิริยารีดอกซ์ เราใช้วิธีสมดุลทางอิเล็กทรอนิกส์ ซึ่งมีการรวบรวมสมการ OVR ที่สมบูรณ์ตามลำดับต่อไปนี้:
1. เขียนแผนภาพแสดงปฏิกิริยาระบุสารที่ทำปฏิกิริยาและสารที่เกิดจากปฏิกิริยา เช่น
2. กำหนดสถานะออกซิเดชันของอะตอมและเขียนเครื่องหมายและค่าของมันไว้เหนือสัญลักษณ์ขององค์ประกอบ โดยสังเกตองค์ประกอบที่สถานะออกซิเดชันเปลี่ยนแปลงไป:
3. เขียนสมการทางอิเล็กทรอนิกส์สำหรับปฏิกิริยาออกซิเดชันและการรีดักชัน กำหนดจำนวนอิเล็กตรอนที่บริจาคโดยตัวรีดิวซ์และยอมรับโดยตัวออกซิไดซ์ จากนั้นทำให้เท่ากันโดยการคูณด้วยสัมประสิทธิ์ที่เหมาะสม:
4. ค่าสัมประสิทธิ์ที่ได้รับซึ่งสอดคล้องกับความสมดุลทางอิเล็กทรอนิกส์จะถูกโอนไปยังสมการหลัก:
5. ปรับจำนวนอะตอมและไอออนที่ไม่เปลี่ยนสถานะออกซิเดชันให้เท่ากัน (ตามลำดับ: โลหะ อโลหะ ไฮโดรเจน):
6. ตรวจสอบความถูกต้องของการเลือกสัมประสิทธิ์ตามจำนวนอะตอมออกซิเจนทางด้านซ้ายและด้านขวาของสมการปฏิกิริยา - ควรเท่ากัน (ในสมการนี้ 24 = 18 + 2 + 4, 24 = 24)
ลองดูตัวอย่างที่ซับซ้อนกว่านี้:
ให้เราตรวจสอบสถานะออกซิเดชันของอะตอมในโมเลกุล:
มาสร้างสมการทางอิเล็กทรอนิกส์สำหรับปฏิกิริยาออกซิเดชันและการรีดักชัน และปรับจำนวนอิเล็กตรอนที่กำหนดและยอมรับให้เท่ากัน:
ลองโอนค่าสัมประสิทธิ์ไปที่สมการหลัก:
มาทำให้จำนวนอะตอมเท่ากันที่ไม่เปลี่ยนสถานะออกซิเดชัน:
โดยการนับจำนวนอะตอมออกซิเจนทางด้านขวาและด้านซ้ายของสมการ เราจะตรวจสอบให้แน่ใจว่าได้เลือกค่าสัมประสิทธิ์อย่างถูกต้อง
สารออกซิไดซ์และรีดิวซ์ที่สำคัญที่สุด
คุณสมบัติรีดอกซ์ขององค์ประกอบขึ้นอยู่กับโครงสร้างของเปลือกอิเล็กทรอนิกส์ของอะตอมและถูกกำหนดโดยตำแหน่งในตารางธาตุของ Mendeleev
โลหะซึ่งมีอิเล็กตรอน 1-3 ตัวอยู่ที่ระดับพลังงานภายนอก จะยอมปล่อยอิเล็กตรอนออกไปได้ง่ายและแสดงเพียงคุณสมบัติลดลงเท่านั้น อโลหะ (องค์ประกอบของหมู่ IV-VII) สามารถบริจาคและรับอิเล็กตรอนได้ จึงสามารถแสดงคุณสมบัติทั้งรีดิวซ์และออกซิไดซ์ได้ ในช่วงที่เลขอะตอมขององค์ประกอบเพิ่มขึ้น คุณสมบัติรีดิวซ์ของสารเชิงเดี่ยวจะลดลง และคุณสมบัติออกซิไดซ์จะเพิ่มขึ้น ในกลุ่มที่มีเลขลำดับเพิ่มขึ้น คุณสมบัติรีดิวซ์จะเพิ่มขึ้น และคุณสมบัติออกซิไดซ์จะลดลง ดังนั้น, ของสารอย่างง่ายตัวรีดิวซ์ที่ดีที่สุดคือโลหะอัลคาไลอลูมิเนียมไฮโดรเจนคาร์บอน สารออกซิไดซ์ที่ดีที่สุดคือฮาโลเจนและออกซิเจน.
คุณสมบัติรีดอกซ์ของสารเชิงซ้อนขึ้นอยู่กับระดับของการเกิดออกซิเดชันของอะตอมที่ประกอบเป็นสารเหล่านั้น สารที่มีอะตอมที่มีสถานะออกซิเดชันต่ำที่สุดจะมีคุณสมบัติรีดิวซ์- สารรีดิวซ์ที่สำคัญที่สุดคือคาร์บอนมอนอกไซด์  ,ไฮโดรเจนซัลไฟด์
,ไฮโดรเจนซัลไฟด์  , เหล็ก(II) ซัลเฟต
, เหล็ก(II) ซัลเฟต  .สารที่มีอะตอมที่มีสถานะออกซิเดชันสูงสุดจะแสดงคุณสมบัติออกซิไดซ์- สารออกซิไดซ์ที่สำคัญที่สุดคือโพแทสเซียมเปอร์แมงกาเนต
.สารที่มีอะตอมที่มีสถานะออกซิเดชันสูงสุดจะแสดงคุณสมบัติออกซิไดซ์- สารออกซิไดซ์ที่สำคัญที่สุดคือโพแทสเซียมเปอร์แมงกาเนต  ,โพแทสเซียมไดโครเมต
,โพแทสเซียมไดโครเมต  , ไฮโดรเจนเปอร์ออกไซด์
, ไฮโดรเจนเปอร์ออกไซด์  ,กรดไนตริก
,กรดไนตริก  ,กรดซัลฟิวริกเข้มข้น
,กรดซัลฟิวริกเข้มข้น  .
.
สารที่มีอะตอมซึ่งมีสถานะออกซิเดชันระดับกลางสามารถทำหน้าที่เป็นตัวออกซิไดซ์หรือตัวรีดิวซ์ได้ขึ้นอยู่กับคุณสมบัติของสารที่พวกมันทำปฏิกิริยาและสภาวะของปฏิกิริยา จึงมีปฏิกิริยาโต้ตอบด้วย  กรดซัลฟูรัสมีคุณสมบัติลด:
กรดซัลฟูรัสมีคุณสมบัติลด:
และเมื่อทำปฏิกิริยากับไฮโดรเจนซัลไฟด์จะเป็นตัวออกซิไดซ์:

นอกจากนี้สำหรับสารดังกล่าวปฏิกิริยาออกซิเดชั่น - รีดิวซ์ตัวเองสามารถทำได้โดยเกิดขึ้นพร้อมกับการเพิ่มขึ้นและลดลงในสถานะออกซิเดชันของอะตอมขององค์ประกอบเดียวกันเช่น:
ความแข็งแรงของสารออกซิไดซ์และตัวรีดิวซ์หลายชนิดขึ้นอยู่กับค่า pH ของตัวกลาง ตัวอย่างเช่น, 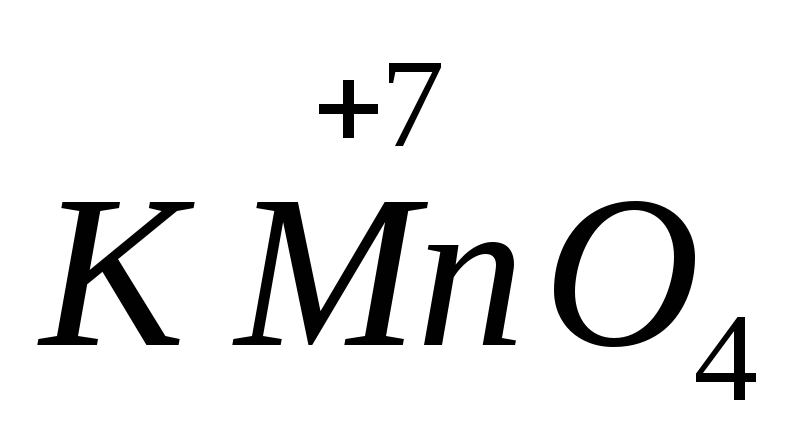 ในสภาพแวดล้อมที่เป็นด่างจะลดลงเหลือ
ในสภาพแวดล้อมที่เป็นด่างจะลดลงเหลือ  เป็นกลางถึง
เป็นกลางถึง  ต่อหน้ากรดซัลฟิวริก - มากถึง
ต่อหน้ากรดซัลฟิวริก - มากถึง  .
.
หากต้องการทราบวิธีสมดุลสมการเคมี คุณต้องรู้จุดประสงค์ของวิทยาศาสตร์นี้ก่อน
คำนิยาม
เคมีศึกษาสาร สมบัติ และการเปลี่ยนแปลง หากไม่มีการเปลี่ยนแปลงสี การตกตะกอน หรือการปล่อยสารที่เป็นก๊าซ ก็จะไม่มีปฏิกิริยาทางเคมีเกิดขึ้น
ตัวอย่างเช่น เมื่อตะไบตะปูเหล็ก โลหะก็จะกลายเป็นผง ในกรณีนี้จะไม่เกิดปฏิกิริยาเคมีเกิดขึ้น
การเผาโพแทสเซียมเปอร์แมงกาเนตจะมาพร้อมกับการก่อตัวของแมงกานีสออกไซด์ (4) การปล่อยออกซิเจนนั่นคือปฏิกิริยาที่สังเกตได้ ในกรณีนี้ คำถามที่เป็นธรรมชาติเกิดขึ้นเกี่ยวกับวิธีการทำให้สมการเคมีเท่ากันอย่างถูกต้อง ลองดูความแตกต่างทั้งหมดที่เกี่ยวข้องกับขั้นตอนดังกล่าว

ลักษณะเฉพาะของการเปลี่ยนแปลงทางเคมี
ปรากฏการณ์ใด ๆ ที่มาพร้อมกับการเปลี่ยนแปลงองค์ประกอบเชิงคุณภาพและปริมาณของสารจะถูกจัดประเภทเป็นการเปลี่ยนแปลงทางเคมี ในรูปแบบโมเลกุล กระบวนการเผาเหล็กในบรรยากาศสามารถแสดงได้โดยใช้เครื่องหมายและสัญลักษณ์
ระเบียบวิธีในการตั้งค่าสัมประสิทธิ์
จะทำให้สัมประสิทธิ์ในสมการเคมีเท่ากันได้อย่างไร? หลักสูตรเคมีระดับมัธยมปลายครอบคลุมวิธีการสมดุลทางอิเล็กทรอนิกส์ มาดูกระบวนการโดยละเอียดกันดีกว่า ขั้นแรกในปฏิกิริยาเริ่มแรกจำเป็นต้องจัดเรียงสถานะออกซิเดชันขององค์ประกอบทางเคมีแต่ละชนิด
มีกฎบางอย่างที่สามารถกำหนดได้สำหรับแต่ละองค์ประกอบ ในสารอย่างง่าย สถานะออกซิเดชันจะเป็นศูนย์ ในสารประกอบไบนารี องค์ประกอบแรกจะมีค่าบวก ซึ่งสอดคล้องกับความจุสูงสุด สำหรับอย่างหลัง พารามิเตอร์นี้ถูกกำหนดโดยการลบหมายเลขกลุ่มออกจากแปดและมีเครื่องหมายลบ สูตรที่ประกอบด้วยสามองค์ประกอบมีความแตกต่างในการคำนวณสถานะออกซิเดชันของตัวเอง
สำหรับองค์ประกอบแรกและองค์ประกอบสุดท้าย ลำดับจะคล้ายกับคำจำกัดความในสารประกอบไบนารี และสมการจะถูกวาดขึ้นเพื่อคำนวณองค์ประกอบตรงกลาง ผลรวมของตัวบ่งชี้ทั้งหมดจะต้องเท่ากับศูนย์ โดยขึ้นอยู่กับสิ่งนี้ ตัวบ่งชี้สำหรับองค์ประกอบตรงกลางของสูตรจะถูกคำนวณ
เรามาพูดคุยกันต่อเกี่ยวกับวิธีทำให้สมการเคมีเท่ากันโดยใช้วิธีสมดุลทางอิเล็กทรอนิกส์ หลังจากกำหนดสถานะออกซิเดชันแล้ว ก็เป็นไปได้ที่จะระบุไอออนหรือสารที่เปลี่ยนค่าระหว่างปฏิกิริยาทางเคมี
เครื่องหมายบวกและลบจะต้องระบุจำนวนอิเล็กตรอนที่ได้รับการยอมรับ (บริจาค) ในระหว่างปฏิกิริยาทางเคมี ตัวคูณร่วมน้อยจะพบระหว่างตัวเลขผลลัพธ์
เมื่อแบ่งเป็นอิเล็กตรอนที่ได้รับและบริจาคจะได้ค่าสัมประสิทธิ์ จะสมดุลสมการเคมีได้อย่างไร? ต้องวางตัวเลขที่ได้รับในงบดุลก่อนสูตรที่เกี่ยวข้อง สิ่งที่ต้องทำเบื้องต้นคือการตรวจสอบปริมาณของแต่ละองค์ประกอบทางด้านซ้ายและด้านขวา หากวางสัมประสิทธิ์อย่างถูกต้อง จำนวนของมันควรจะเท่ากัน

กฎการอนุรักษ์มวลของสาร
เมื่อพูดถึงวิธีสมดุลสมการเคมี ต้องใช้กฎข้อนี้ เมื่อพิจารณาว่ามวลของสารเหล่านั้นที่ทำให้เกิดปฏิกิริยาเคมีเท่ากับมวลของผลิตภัณฑ์ที่เกิดขึ้น จึงเป็นไปได้ที่จะตั้งค่าสัมประสิทธิ์หน้าสูตรได้ ตัวอย่างเช่น จะสมดุลสมการทางเคมีได้อย่างไรหากสารอย่างง่ายอย่างแคลเซียมและออกซิเจนมีปฏิกิริยากัน และหลังจากกระบวนการเสร็จสิ้นก็จะได้ออกไซด์
เพื่อรับมือกับงานนี้จำเป็นต้องคำนึงว่าออกซิเจนเป็นโมเลกุลไดอะตอมมิกที่มีพันธะโควาเลนต์ไม่มีขั้วดังนั้นสูตรจึงเขียนในรูปแบบต่อไปนี้ - O2 ทางด้านขวาเมื่อประกอบแคลเซียมออกไซด์ (CaO) จะคำนึงถึงความจุของแต่ละองค์ประกอบด้วย
ก่อนอื่นคุณต้องตรวจสอบปริมาณออกซิเจนในแต่ละด้านของสมการก่อนว่ามีความแตกต่างกันอย่างไร ตามกฎการอนุรักษ์มวลของสารต้องใส่สัมประสิทธิ์ 2 หน้าสูตรผลิตภัณฑ์ จากนั้นตรวจสอบแคลเซียม เพื่อให้เท่ากัน เราใส่ค่าสัมประสิทธิ์ 2 ไว้หน้าสารตั้งต้น ผลลัพธ์ที่ได้คือ:
- 2Ca+O2=2CaO

การวิเคราะห์ปฏิกิริยาโดยใช้วิธีสมดุลทางอิเล็กทรอนิกส์
จะสมดุลสมการเคมีได้อย่างไร? ตัวอย่างของ OVR จะช่วยตอบคำถามนี้ สมมติว่าจำเป็นต้องจัดเรียงสัมประสิทธิ์ในโครงการที่เสนอโดยใช้วิธีสมดุลทางอิเล็กทรอนิกส์:
- CuO + H2=Cu + H2O
ขั้นแรก เราจะกำหนดสถานะออกซิเดชันให้กับธาตุแต่ละชนิดในสารตั้งต้นและผลิตภัณฑ์จากปฏิกิริยา เราได้รับรูปแบบของสมการดังต่อไปนี้:
- ลูกบาศ์ก(+2)O(-2)+H2(0)=ลูกบาศ์ก(0)+H2(+)O(-2)
ตัวชี้วัดมีการเปลี่ยนแปลงสำหรับทองแดงและไฮโดรเจน เป็นไปตามพื้นฐานของพวกเขาที่เราจะจัดทำยอดคงเหลือทางอิเล็กทรอนิกส์:
- Cu(+2)+2е=Cu(0) 1 สารรีดิวซ์, ออกซิเดชัน;
- H2(0)-2e=2H(+) 1 สารออกซิไดซ์, รีดิวซ์
จากค่าสัมประสิทธิ์ที่ได้รับในเครื่องชั่งอิเล็กทรอนิกส์ เราได้รายการต่อไปนี้สำหรับสมการทางเคมีที่เสนอ:
- CuO+H2=Cu+H2O
ลองใช้ตัวอย่างอื่นที่เกี่ยวข้องกับการตั้งค่าสัมประสิทธิ์:
- H2+O2=H2O.
เพื่อให้โครงการนี้สมดุลตามกฎการอนุรักษ์สาร จำเป็นต้องเริ่มต้นด้วยออกซิเจน เมื่อพิจารณาว่าโมเลกุลไดอะตอมมิกเกิดปฏิกิริยา จะต้องใส่ค่าสัมประสิทธิ์ 2 ไว้หน้าสูตรของผลิตภัณฑ์ที่ทำปฏิกิริยา
- 2H2+O2=2H2O.

บทสรุป
จากความสมดุลทางอิเล็กทรอนิกส์ คุณสามารถใส่ค่าสัมประสิทธิ์ในสมการทางเคมีใดๆ ได้ ผู้สำเร็จการศึกษาจากสถาบันการศึกษาเกรดเก้าและสิบเอ็ดที่เลือกสอบวิชาเคมีจะได้รับงานที่คล้ายกันในภารกิจหนึ่งของการทดสอบขั้นสุดท้าย
อัลกอริทึม
การจัดเรียงสัมประสิทธิ์ในสมการปฏิกิริยาเคมี
ครูสอนวิชาเคมี ม.บูรพา มัธยมศึกษาปีที่ 2
โวโลดเชนโก สเวตลานา นิโคเลฟนา
อุสซูริสค์
การจัดเรียงค่าสัมประสิทธิ์ในสมการของปฏิกิริยาเคมี
จำนวนอะตอมขององค์ประกอบหนึ่งทางด้านซ้ายของสมการจะต้องเท่ากับจำนวนอะตอมขององค์ประกอบนั้นทางด้านขวาของสมการ
ภารกิจที่ 1 (สำหรับกลุ่ม)กำหนดจำนวนอะตอมขององค์ประกอบทางเคมีแต่ละชนิดที่มีส่วนร่วมในปฏิกิริยา
1. คำนวณจำนวนอะตอม:
ก) ไฮโดรเจน: 8NH3, NaOH, 6NaOH, 2NaOH,นิวซีแลนด์4, 2H2SO4, 3H2S04, 8H2SO4;
6) ออกซิเจน: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. คำนวณจำนวนอะตอม: ก)ไฮโดรเจน:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
b) ออกซิเจน:
1) 2СО + 02 2) С02 + 2Н.О 3)4NO2 + 2H2O + O2
อัลกอริธึมในการจัดเรียงสัมประสิทธิ์ในสมการปฏิกิริยาเคมี
А1 + О2→ А12О3A1-1 อะตอม A1-2
O-2 อะตอม O-3
2. ในบรรดาองค์ประกอบที่มีจำนวนอะตอมต่างกันในส่วนซ้ายและขวาของแผนภาพ ให้เลือกองค์ประกอบที่มีจำนวนอะตอมมากกว่า
อะตอม O-2 ทางด้านซ้าย
อะตอม O-3 ทางด้านขวา
3. ค้นหาตัวคูณร่วมน้อย (LCM) ของจำนวนอะตอมขององค์ประกอบนี้ทางด้านซ้ายของสมการ และจำนวนอะตอมขององค์ประกอบนี้ทางด้านขวาของสมการ
ล.ซม. = 6
4. หาร LCM ด้วยจำนวนอะตอมขององค์ประกอบนี้ทางด้านซ้ายของสมการ จะได้ค่าสัมประสิทธิ์ทางด้านซ้ายของสมการ
6:2 = 3
อัล + โซ 2 →อัล 2 เกี่ยวกับ 3
5. หาร LCM ด้วยจำนวนอะตอมขององค์ประกอบนี้ทางด้านขวาของสมการ จะได้ค่าสัมประสิทธิ์ทางด้านขวาของสมการ
6:3 = 2
A1+ โอ 2 →2A1 2 O3
6. หากค่าสัมประสิทธิ์ที่ตั้งไว้เปลี่ยนจำนวนอะตอมขององค์ประกอบอื่น ให้ทำซ้ำขั้นตอนที่ 3, 4, 5 อีกครั้ง
A1 + โซ 2 → →2A1 2 เกี่ยวกับ 3
A1 -1 อะตอม A1 - 4
ล.ซม. = 4
4:1=4 4:4=1
4A1 + โซ 2 → →2A1 2 เกี่ยวกับ 3
. การทดสอบการได้มาซึ่งความรู้เบื้องต้น (8-10 นาที .).
มีอะตอมออกซิเจน 2 อะตอมทางด้านซ้ายของแผนภาพ และอีก 1 อะตอมอยู่ทางด้านขวา จำนวนอะตอมจะต้องเท่ากันโดยใช้สัมประสิทธิ์
1)2มก.+O2 →2MgO
2) CaCO3 + 2HCl→CaCl2 + เอ็น2 โอ + โค2
ภารกิจที่ 2 ใส่ค่าสัมประสิทธิ์ลงในสมการของปฏิกิริยาเคมี (โปรดทราบว่าค่าสัมประสิทธิ์จะเปลี่ยนจำนวนอะตอมของธาตุเดียวเท่านั้น):
1. เฟ 2 โอ 3 + ก ล → ก ล 2 เกี่ยวกับ 3 + เฟ; มก.+เอ็น 2 → มก 3 เอ็น 2 ;
2. อัล + เอส → อัล 2 ส 3 - A1+ กับ → อัล 4 ค 3 ;
3. อัล + Cr 2 โอ 3 → Cr+อัล 2 โอ 3 - แคลเซียม+พี → แคลิฟอร์เนีย 3 ป 2 ;
4. ซี + ชม 2 → ช 4 ; แคลิฟอร์เนีย + ซี → SaS 2 ;
5. เฟ + โอ 2 → เฟ 3 โอ 4 - ศรี+มก → มก 2 ศรี;
6/.นา+ส → นา 2 เอส; CaO+ กับ → ซีเอซี 2 + คาร์บอนไดออกไซด์;
7.แคลเซียม+เอ็น 2 → ค ก 3 เอ็น 2 - ซิ+คลี 2 → SiCl 4 ;
8. เอจี+เอส → อจ 2 เอส; เอ็น 2 + กับ ล 2 → NS ลิตร;
9.น 2 + โอ 2 → เลขที่; บจก 2 + กับ → บจก ;
10. สวัสดี → เอ็น 2 → + 1 2 - มก.+ NS ล → MgCl 2 + เอ็น 2 ;
11.เฟส+ NS 1 → FeCl 2 +ฮ 2 เอส; สังกะสี+HCl → สังกะสี 2 +ฮ 2 ;
12. บ 2 +คิ → เคบีอาร์+ไอ 2 - ศรี+HF (ร) → ซิฟ 4 +ฮ 2 ;
1./HCl+Na 2 บจก 3 → บจก 2 +ฮ 2 O+ โซเดียมคลอไรด์; เคซีแอลโอ 3 +ส → → KCl+ เอสโอ 2 ;
14. Cl 2 + เคบีอาร์ → KCl + Br 2 - SiO 2 + กับ → ศรี + CO;
15. ซีโอ 2 + กับ → SiC + CO; มก. + SiO 2 → มก 2 ศรี + MgO
16. มก 2 ศรี + เอชซีแอล → MgCl 2 + SiH 4
1.สมการของปฏิกิริยาเคมีคืออะไร?
2.ด้านขวาของสมการเขียนว่าอะไร? และทางซ้าย?
3.เครื่องหมาย “+” ในสมการหมายถึงอะไร
4. เหตุใดจึงใส่สัมประสิทธิ์ในสมการเคมี?