در درس 13 "" از دوره " شیمی برای آدمک ها» در نظر بگیرید که معادلات شیمیایی برای چه هستند. ما یاد خواهیم گرفت که چگونه واکنش های شیمیایی را با قرار دادن صحیح ضرایب برابر کنیم. این درس به شما نیاز دارد که شیمی پایه را از درس های قبلی بدانید. برای مشاهده دقیق فرمول های تجربی و تجزیه و تحلیل شیمیایی، حتما در مورد آنالیز عنصری مطالعه کنید.
در نتیجه واکنش احتراق متان CH 4 در اکسیژن O 2 ، دی اکسید کربن CO 2 و آب H 2 O تشکیل می شود که این واکنش را می توان توصیف کرد. معادله شیمیایی:
- CH 4 + O 2 → CO 2 + H 2 O (1)
بیایید سعی کنیم بیشتر از یک نشانه، اطلاعات بیشتری از معادله شیمیایی استخراج کنیم محصولات و معرف هاواکنش ها معادله شیمیایی (1) کامل نیست و بنابراین هیچ اطلاعاتی در مورد اینکه چه تعداد مولکول O 2 در هر 1 مولکول CH 4 مصرف می شود و چه تعداد مولکول CO 2 و H2 O در نتیجه به دست می آید، ارائه نمی دهد. اما اگر ضرایب عددی را جلوی فرمول های مولکولی مربوطه بنویسیم که نشان می دهد چند مولکول از هر نوع در واکنش شرکت می کنند، آنگاه به دست می آوریم. معادله کامل شیمیاییواکنش ها
برای تکمیل ترکیب معادله شیمیایی (1)، باید یک قانون ساده را به خاطر بسپارید: سمت چپ و راست معادله باید دارای تعداد اتم های یکسانی از هر نوع باشد، زیرا هیچ اتم جدیدی در دوره ایجاد نمی شود. یک واکنش شیمیایی است و هیچ واکنش موجود از بین نمی رود. این قانون بر اساس قانون بقای جرم است که در ابتدای فصل به آن پرداختیم.
برای بدست آوردن کامل از یک معادله شیمیایی ساده ضروری است. بنابراین، اجازه دهید به معادله مستقیم واکنش (1) برویم: دوباره به معادله شیمیایی نگاه کنید، دقیقاً به اتمها و مولکولهای سمت راست و چپ. به راحتی می توان فهمید که سه نوع اتم در واکنش شرکت می کنند: کربن C، هیدروژن H و اکسیژن O. بیایید تعداد اتم های هر نوع را در سمت راست و چپ معادله شیمیایی بشماریم و با هم مقایسه کنیم.

بیایید با کربن شروع کنیم. در سمت چپ، یک اتم C بخشی از مولکول CH 4 است و در سمت راست، یک اتم C بخشی از CO 2 است. بنابراین، تعداد اتم های کربن در سمت چپ و سمت راست یکسان است، بنابراین آن را به حال خود رها می کنیم. اما برای وضوح، ما ضریب 1 را در مقابل مولکول های کربن قرار می دهیم، اگرچه این لازم نیست:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
سپس به شمارش اتم های هیدروژن H ادامه می دهیم. در سمت چپ 4 اتم H (به معنای کمی H 4 = 4H) در ترکیب مولکول CH 4 وجود دارد و در سمت راست - فقط 2 اتم H در ترکیب مولکول H 2 O که دو برابر کمتر از سمت چپ معادله شیمیایی (2) است. بیایید مساوی کنیم! برای این کار ضریب 2 را در مقابل مولکول H 2 O قرار می دهیم اکنون 4 مولکول هیدروژن H در هر دو واکنشگر و فرآورده خواهیم داشت:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
لطفاً توجه داشته باشید که ضریب 2 که در مقابل مولکول آب H 2 O برای یکسان سازی هیدروژن H نوشتیم، تمام اتم های تشکیل دهنده ترکیب آن را دو برابر می کند، یعنی 2H 2 O یعنی 4H و 2O. بسیار خوب، به نظر می رسد که این موضوع مرتب شده است، باقی مانده است که تعداد اتم های اکسیژن O در معادله شیمیایی (3) محاسبه و مقایسه شود. بلافاصله توجه را جلب می کند که در سمت چپ اتم های O دقیقاً 2 برابر کمتر از سمت راست است. اکنون شما می دانید که چگونه معادلات شیمیایی را خودتان یکسان کنید، بنابراین من بلافاصله نتیجه نهایی را می نویسم:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O یا CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
همانطور که می بینید، یکسان سازی واکنش های شیمیایی چیز پیچیده ای نیست، و این شیمی نیست که در اینجا مهم است، بلکه ریاضیات است. معادله (4) نامیده می شود معادله کاملواکنش شیمیایی، زیرا قانون بقای جرم در آن رعایت می شود، یعنی. تعداد اتم های هر نوع وارد واکنش دقیقاً با تعداد اتم های این نوع در پایان واکنش مطابقت دارد. هر قسمت از این معادله شیمیایی کامل شامل 1 اتم کربن، 4 اتم هیدروژن و 4 اتم اکسیژن است. با این حال، ارزش درک چند نکته مهم را دارد: یک واکنش شیمیایی دنباله پیچیده ای از مراحل میانی جداگانه است، و بنابراین، برای مثال، غیرممکن است که معادله (4) را به این معنا تفسیر کنیم که 1 مولکول متان باید به طور همزمان با آن برخورد کند. 2 مولکول اکسیژن فرآیندهایی که در طول تشکیل محصولات واکنش رخ می دهد بسیار پیچیده تر است. نکته دوم: معادله کامل واکنش چیزی در مورد مکانیسم مولکولی آن، یعنی در مورد توالی رویدادهایی که در سطح مولکولی در طول سیر آن رخ می دهد، به ما نمی گوید.
ضرایب در معادلات واکنش های شیمیایی
مثال خوب دیگری از نحوه درست چیدمان شانسدر معادلات واکنش های شیمیایی: Trinitrotoluene (TNT) C 7 H 5 N 3 O 6 به شدت با اکسیژن ترکیب می شود و H 2 O ، CO 2 و N 2 را تشکیل می دهد. معادله واکنش را می نویسیم که برابر می کنیم:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
نوشتن معادله کامل بر اساس دو مولکول TNT آسان تر است، زیرا سمت چپ دارای تعداد فرد اتم هیدروژن و نیتروژن است و سمت راست دارای یک عدد زوج است:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
سپس مشخص می شود که 14 اتم کربن، 10 اتم هیدروژن و 6 اتم نیتروژن باید به 14 مولکول دی اکسید کربن، 5 مولکول آب و 3 مولکول نیتروژن تبدیل شوند:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
اکنون هر دو بخش شامل تعداد یکسانی از همه اتم ها به جز اکسیژن هستند. از 33 اتم اکسیژن موجود در سمت راست معادله، 12 اتم توسط دو مولکول اصلی TNT و 21 اتم باقی مانده باید توسط مولکول های 10.5 O 2 تامین شوند. بنابراین، معادله شیمیایی کامل به صورت زیر خواهد بود:
- 2C 7 H 5 N 3 O 6 + 10.5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
می توانید هر دو طرف را در 2 ضرب کنید و از شر ضریب غیر صحیح 10.5 خلاص شوید:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
اما این را نمی توان انجام داد، زیرا لازم نیست همه ضرایب معادله اعداد صحیح باشند. درست تر است که یک معادله بر اساس یک مولکول TNT ایجاد کنیم:
- C 7 H 5 N 3 O 6 + 5.25O 2 → 7CO 2 + 2.5H 2 O + 1.5N 2 (10)
معادله کامل شیمیایی (9) حاوی اطلاعات زیادی است. اول از همه، این مواد اولیه را نشان می دهد - معرف ها، و محصولاتواکنش ها علاوه بر این، نشان می دهد که در جریان واکنش، همه اتم ها از هر نوع به طور جداگانه حفظ می شوند. اگر هر دو طرف رابطه (9) را در عدد آووگادرو N A = 6.022 10 23 ضرب کنیم، می توانیم بیان کنیم که 4 مول TNT با 21 مول O 2 واکنش داده و 28 مول CO 2 ، 10 مول H 2 O و 6 مول N 2 .
یک ویژگی دیگر وجود دارد. با استفاده از جدول تناوبی، وزن مولکولی همه این مواد را تعیین می کنیم:
- C 7 H 5 N 3 O 6 \u003d 227.13 گرم در مول
- O2 = 31.999 گرم در مول
- CO2 = 44.010 گرم در مول
- H2O = 18.015 گرم در مول
- N2 = 28.013 گرم در مول
اکنون معادله 9 نیز نشان خواهد داد که 4 227.13 گرم \u003d 908.52 گرم TNT به 21 31.999 گرم \u003d 671.98 گرم اکسیژن برای تکمیل واکنش نیاز دارد و در نتیجه 28 44.010 g = 8 1 g = 2003d 12 CO2 تشکیل می شود. 180.15 گرم H 2 O و 6 28.013 گرم = 168.08 گرم N 2. بیایید بررسی کنیم که آیا قانون بقای جرم در این واکنش برآورده شده است یا خیر:
| معرف ها | محصولات | |
| 908.52 گرم TNT | 1232.3 گرم CO2 | |
| 671.98 گرم CO2 | 180.15 گرم H2O | |
| 168.08 گرم N2 | ||
| جمع | 1580.5 گرم | 1580.5 گرم |
اما لازم نیست تک تک مولکول ها در یک واکنش شیمیایی شرکت کنند. به عنوان مثال، واکنش سنگ آهک CaCO3 و اسید هیدروکلریک هیدروکلریک، با تشکیل محلول آبی از کلرید کلسیم CaCl2 و دی اکسید کربن CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
معادله شیمیایی (11) واکنش کربنات کلسیم CaCO 3 (سنگ آهک) و اسید هیدروکلریک HCl را برای تشکیل محلول آبی از کلرید کلسیم CaCl 2 و دی اکسید کربن CO 2 توصیف می کند. این معادله کامل است، زیرا تعداد اتم های هر نوع در سمت چپ و راست آن یکسان است.
منظور از این معادله است سطح ماکروسکوپی (مولاری).به شرح زیر است: 1 مول یا 100.09 گرم CaCO 3 برای تکمیل واکنش به 2 مول یا 72.92 گرم HCl نیاز دارد که در نتیجه 1 مول CaCl 2 (110.99 گرم در مول)، CO 2 (44.01 گرم در مول) و H 2 ایجاد می شود. O (18.02 گرم در مول). از این داده های عددی، به راحتی می توان تأیید کرد که قانون بقای جرم در این واکنش رعایت شده است.
تفسیر معادله (11) بر سطح میکروسکوپی (مولکولی).چندان واضح نیست، زیرا کربنات کلسیم یک نمک است نه یک ترکیب مولکولی، و بنابراین درک معادله شیمیایی (11) غیرممکن است به این معنا که 1 مولکول کربنات کلسیم CaCO 3 با 2 مولکول HCl واکنش می دهد. علاوه بر این، مولکول HCl در محلول به طور کلی به یون های H + و Cl - تجزیه می شود (تجزیه می شود). بنابراین، توصیف صحیح تر از آنچه در این واکنش در سطح مولکولی رخ می دهد، معادله را به دست می دهد:
- CaCO 3 (جامد) + 2H + (aq.) → Ca 2+ (aq.) + CO 2 (g.) + H 2 O (l.) (12)
در اینجا، در پرانتز، وضعیت فیزیکی هر نوع ذرات به اختصار آمده است ( تلویزیون.- سخت، ق.یک یون هیدراته در محلول آبی است، جی.- گاز، و- مایع).
معادله (12) نشان می دهد که CaCO 3 جامد با دو یون H + هیدراته واکنش می دهد تا یک یون Ca 2 + مثبت، CO 2 و H 2 O تشکیل دهد. معادله (12)، مانند دیگر معادلات شیمیایی کامل، ایده ای از واکنش مکانیسم مولکولی است و برای شمارش مقدار مواد راحت تر است، با این حال، توصیف بهتری از آنچه در سطح میکروسکوپی اتفاق می افتد ارائه می دهد.
دانش خود را در مورد فرمول بندی معادلات شیمیایی با تجزیه و تحلیل مستقل مثال با راه حل تثبیت کنید:
امیدوارم از درس 13" تدوین معادلات شیمیایی» چیز جدیدی برای خودتان یاد گرفتید. اگر سوالی دارید در نظرات بنویسید.
L  آیا ترتیب ضرایب در معادلات شیمیایی آسان است؟
آیا ترتیب ضرایب در معادلات شیمیایی آسان است؟
بچه های من اینجا هستند و تا شیمی بزرگ شده اند (من معلم کلاس هشتم "ب" هستم). شیمی اغلب در اولین درس به کودکان داده می شود ، اما پنجشنبه من اولین درس را ندارم و از والنتینا ایوانونا درسی خواستم "به بچه ها نگاه کنم" و خاطرات را بررسی کنم. موضوع من را مجذوب خود کرد ، در مدرسه شیمی را دوست داشتم و خاطرات را بررسی نمی کردم. یک بار دیگر متقاعد شدم که دانشآموزان اغلب به دلیل اینکه ارتباطات بین رشتهای را نمیبینند، مشکلاتی را تجربه میکنند. در این درس شیمی دانش آموزان باید با دانستن ظرفیت مواد شیمیایی معادلات شیمیایی می نوشتند. و بسیاری از دانش آموزان در تعیین ضرایب عددی مشکل داشتند. درس بعدی شیمی روز شنبه با والنتینا ایوانونا گذرانده شد.
تمرین 1.
جملات زیر را به صورت معادلات شیمیایی بنویسید:
الف) "در طی پخت کربنات کلسیم، اکسید کلسیم و مونوکسید کربن (IV) تشکیل می شود. ب) هنگامی که اکسید فسفر (V) با آب واکنش می دهد، اسید فسفریک به دست می آید.
راه حل:
الف) CaCO 3 \u003d CaO + CO 2 - واکنش گرماگیر است. هیچ مشکلی در این کار وجود نداشت، زیرا نیازی به جستجوی ضرایب عددی نبود. در ابتدا در قسمت چپ و راست برابری، هر کدام یک اتم کلسیم، یک اتم کربن و سه اتم اکسیژن.
ب) P 2 O 5 + 3H 2 O \u003d 2H 3 PO 4 - واکنش گرمازا است. مشکلات با معادله دوم به وجود آمد، بدون ضرایب عددی، برابری صحیح به دست نیامد: P 2 O 5 + H 2 O → H 3 PO 4. بدیهی است که برای کامپایل برابری صحیح باید ضرایب عددی را انتخاب کنید. اگر انتخاب کردید، می توانید با فسفر شروع کنید: دو اتم در سمت چپ و یکی در سمت راست وجود دارد، بنابراین یک ضریب عددی برابر با دو را در مقابل فرمول اسید نیتریک قرار می دهیم و سپس به دست می آوریم: P 2 O 5 + H 2 O → 2H 3 PO 4. اما اکنون باقی مانده است که تعداد اتم های اکسیژن و هیدروژن را برابر کنیم: دو اتم هیدروژن در سمت چپ و شش اتم در سمت راست وجود دارد، بنابراین ضریب عددی برابر با سه را در مقابل فرمول آب قرار می دهیم و سپس به دست می آوریم: P 2 O 5 + 3H 2 O → 2H 3 PO 4. اکنون به راحتی می توان مطمئن شد که در هر قسمت از معادله مقادیر مساوی اتم های فسفر و اتم های هیدروژن و اتم های اکسیژن وجود دارد، بنابراین، معادله واکنش شیمیایی صحیح را به دست آورده ایم: P 2 O 5 + 3H 2 O \u003d 2H 3 PO 4.
راه دوم: جبریفرض کنید سه ضریب در معادله قرار می دهیم الف، ب، ج در نتیجه معادله واکنش شیمیایی صحیح است: آ P2O5+ V H 2 O = با H3PO4. از آنجایی که معادله از اتم های سه نوع استفاده می کند، سیستمی از سه معادله خطی با سه مجهول تشکیل می دهیم. الف، درو با .
موادی که در واکنش شیمیایی استفاده شد: P - فسفر. O 2 - اکسیژن؛ P 2 O 5 - اکسید فسفر (V).
ج) Fe 2 (SO 4) 3 + KOH → Fe (OH) 3 + K 2 SO 4.
موادی که در واکنش شیمیایی مورد استفاده قرار گرفتند: Fe 2 (SO 4) 3 - سولفات آهن (III). KOH، هیدروکسید پتاسیم؛ Fe (OH) 3 - آهن (III) هیدروکسید؛ K 2 SO 4 - سولفات پتاسیم.
د) CuOH → Cu 2 O + H 2 O.
راه حل: 2CuOH \u003d Cu 2 O + H 2 O. مشکل تعیین ضرایب عددی با تدوین یک سیستم معادلات حل شد: 
موادی که در واکنش شیمیایی استفاده شد: CuOH - مس (I) هیدروکسید. Cu 2 O - اکسید مس (I)؛ H 2 O - آب.
ه) CS 2 + O 2 → CO 2 + SO 2.
راه حل: CS 2 + 3O 2 \u003d CO 2 + 2SO 2. با انتخاب ضرایب تصمیم گرفت: تعداد اتم های گوگرد را برابر کرد (2). تعداد اتم های اکسیژن را برابر کرد (3).
موادی که در واکنش شیمیایی مورد استفاده قرار گرفتند: CS 2 - سولفور گوگرد (IV). O2-
موادی که در واکنش شیمیایی مورد استفاده قرار گرفتند: FeS 2 - پیریت ها. O 2 - اکسیژن؛ Fe 2 O 3 - اکسید آهن (III)؛ SO 2 - اکسید گوگرد (IV).
تمرین 3
(پیشنهاد شد به عنوان یک کار مستقل حل شود).
وضعیت:
معادلات واکنش های شیمیایی را با توجه به طرح های زیر بنویسید:
الف) اسید فسفریک + هیدروکسید سدیم → فسفات سدیم + آب.
ب) اکسید سدیم + آب → هیدروکسید سدیم.
ج) اکسید آهن (II) + آلومینیوم → اکسید آلومینیوم + آهن؛
د) هیدروکسید مس (II) → اکسید مس (II) + آب.
پاسخ:
الف) 2H 3 PO 4 + 6NaOH \u003d 2Na 3 PO 4 + 6H 2 O.
ب) Na 2 O + H 2 O \u003d 2NaOH.
ج) 3FeO + 2Al = Al 2 O 3 + 3Fe;
د) Cu (OH) 2 \u003d CuO + H 2 O.
در 10 دقیقه، 85٪ از دانش آموزان این کار را با نمرات عالی به پایان رساندند که والنتینا ایوانونا را به طرز خوشایندی شگفت زده کرد.
روش های مختلفی برای تعیین ضرایب در معادلات واکنش های ردوکس وجود دارد. ما از روش تراز الکترونیکی استفاده می کنیم که در آن کامپایل معادله کامل OVR به ترتیب زیر انجام می شود:
1. یک طرح واکنش ترسیم کنید، که موادی را که واکنش نشان داده اند و مواد حاصل از واکنش را نشان می دهد، به عنوان مثال:
2. حالت اکسیداسیون اتم ها را مشخص کنید و علامت و مقدار آن را بالای علامت عناصر بنویسید و عناصری را که حالت اکسیداسیون آنها تغییر کرده است علامت بزنید:
3. معادلات الکترونیکی واکنش های اکسیداسیون و احیا را بنویسید، تعداد الکترون های اهدا شده توسط عامل احیا کننده و پذیرفته شده توسط عامل اکسید کننده را تعیین کنید و سپس با ضرب در ضرایب مناسب آنها را برابر کنید:
4. ضرایب به دست آمده مربوط به تراز الکترونیکی به معادله اصلی منتقل می شود:
5. تعداد اتم ها و یون هایی که درجه اکسیداسیون را تغییر نمی دهند برابر کنید (به ترتیب: فلزات، غیرفلزات، هیدروژن):
6. صحت انتخاب ضرایب را با تعداد اتم های اکسیژن در قسمت های چپ و راست معادله واکنش بررسی کنید - آنها باید برابر باشند (در این معادله 24 = 18 + 2 + 4، 24 = 24).
بیایید به یک مثال پیچیده تر نگاه کنیم:
حالات اکسیداسیون اتم ها را در مولکول ها تعیین می کنیم:
ما معادلات الکترونیکی را برای واکنش های اکسیداسیون و کاهش می سازیم و تعداد الکترون های داده شده و دریافتی را برابر می کنیم:
بیایید ضرایب را به معادله اصلی منتقل کنیم:
تعداد اتم هایی را که حالت اکسیداسیون را تغییر نمی دهند برابر کنید:
با شمارش تعداد اتم های اکسیژن در سمت راست و چپ معادله، مطمئن می شویم که ضرایب به درستی انتخاب شده اند.
مهمترین عوامل اکسید کننده و کاهنده
خواص ردوکس عناصر به ساختار لایه الکترونی اتم ها بستگی دارد و با موقعیت آنها در سیستم تناوبی مندلیف تعیین می شود.
فلزات با داشتن 1 تا 3 الکترون در سطح انرژی خارجی به راحتی آنها را از بین می برند و فقط خواص کاهشی از خود نشان می دهند. غیر فلزات (عناصر گروه های IV-VII) می توانند هم الکترون اهدا و هم بپذیرند، بنابراین می توانند هم خاصیت کاهنده و هم اکسید کننده از خود نشان دهند. در دورههایی که تعداد ترتیبی عنصر افزایش مییابد، خواص کاهنده مواد ساده ضعیف میشود و خاصیت اکسیدکننده افزایش مییابد. در گروههایی که تعداد سریال افزایش مییابد، خواص کاهشی افزایش یافته و خواص اکسیداتیو ضعیف میشود. بدین ترتیب، از مواد ساده، بهترین عوامل کاهنده فلزات قلیایی، آلومینیوم، هیدروژن، کربن هستند. بهترین عوامل اکسید کننده هالوژن و اکسیژن هستند.
خواص ردوکس مواد پیچیده به درجه اکسیداسیون اتم هایی که ترکیب آنها را تشکیل می دهند بستگی دارد. موادی که حاوی اتم هایی با کمترین حالت اکسیداسیون هستند، خواص کاهشی از خود نشان می دهند. مهمترین عوامل کاهنده مونوکسید کربن است.  ، سولفید هیدروژن
، سولفید هیدروژن  سولفات آهن (II).
سولفات آهن (II).  .موادی که حاوی اتم هایی با بالاترین حالت اکسیداسیون هستند، خاصیت اکسید کنندگی از خود نشان می دهند. مهمترین عامل اکسید کننده پرمنگنات پتاسیم است
.موادی که حاوی اتم هایی با بالاترین حالت اکسیداسیون هستند، خاصیت اکسید کنندگی از خود نشان می دهند. مهمترین عامل اکسید کننده پرمنگنات پتاسیم است  ، دی کرومات پتاسیم
، دی کرومات پتاسیم  ، آب اکسیژنه
، آب اکسیژنه  ، اسید نیتریک
، اسید نیتریک  ، اسید سولفوریک غلیظ
، اسید سولفوریک غلیظ  .
.
مواد حاوی اتمهایی با حالت اکسیداسیون متوسط میتوانند بهعنوان عامل اکسیدکننده یا کاهنده رفتار کنند.بسته به خواص موادی که با آنها تعامل دارند و شرایط واکنش. بنابراین در واکنش با  اسید سولفوریک خواص کاهشی را نشان می دهد:
اسید سولفوریک خواص کاهشی را نشان می دهد:
و هنگام تعامل با سولفید هیدروژن، یک عامل اکسید کننده است:

علاوه بر این، برای چنین موادی، واکنش های خود اکسیداسیون-بازیابی خود امکان پذیر است که با افزایش و کاهش همزمان درجه اکسیداسیون اتم های همان عنصر رخ می دهد، به عنوان مثال:
قدرت بسیاری از عوامل اکسید کننده و کاهنده به pH محیط بستگی دارد. مثلا، 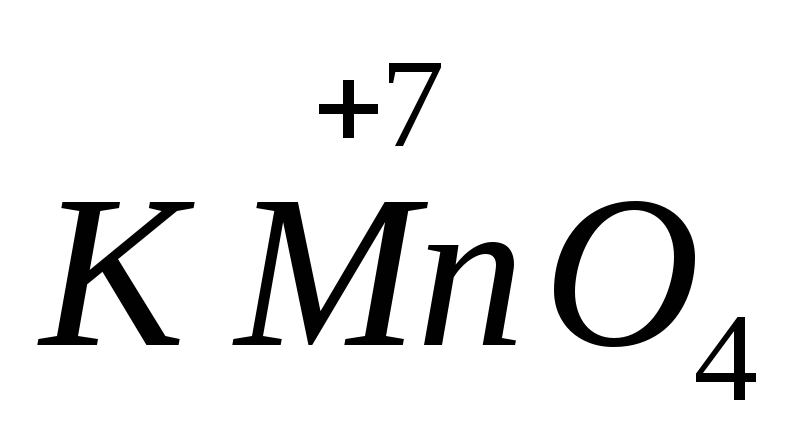 در یک محیط قلیایی به کاهش می یابد
در یک محیط قلیایی به کاهش می یابد  ، در خنثی به
، در خنثی به  ، در حضور اسید سولفوریک - تا
، در حضور اسید سولفوریک - تا  .
.
برای اینکه بفهمید چگونه یک معادله شیمیایی را برابر کنید، ابتدا باید هدف این علم را بدانید.
تعریف
شیمی مواد، خواص و تبدیل آنها را مطالعه می کند. اگر هیچ تغییری در رنگ، بارش، انتشار یک ماده گازی وجود نداشته باشد، هیچ فعل و انفعال شیمیایی رخ نمی دهد.
به عنوان مثال، هنگام سوهان زدن یک میخ آهنی با سوهان، فلز به سادگی به پودر تبدیل می شود. در این حالت هیچ واکنش شیمیایی رخ نمی دهد.
کلسینه شدن پرمنگنات پتاسیم با تشکیل اکسید منگنز (4)، آزاد شدن اکسیژن، یعنی یک تعامل مشاهده می شود، همراه است. در این مورد، یک سوال کاملا طبیعی در مورد چگونگی یکسان سازی صحیح معادلات شیمیایی مطرح می شود. ما تمام تفاوت های ظریف مرتبط با چنین روشی را تجزیه و تحلیل خواهیم کرد.

ویژگی تبدیل های شیمیایی
هر پدیده ای که با تغییر در ترکیب کیفی و کمی مواد همراه باشد، تبدیل شیمیایی است. در شکل مولکولی، فرآیند احتراق آهن در جو را می توان با استفاده از علائم و نشانه ها بیان کرد.
روش قرار دادن ضرایب
چگونه ضرایب را در معادلات شیمیایی برابر کنیم؟ در درس شیمی دبیرستان روش تراز الکترونیکی تحلیل می شود. بیایید روند را با جزئیات بیشتری در نظر بگیریم. برای شروع، در واکنش اولیه، لازم است که حالت های اکسیداسیون هر عنصر شیمیایی ترتیب داده شود.
قوانین خاصی وجود دارد که می توان آنها را برای هر عنصر تعیین کرد. در مواد ساده، حالت های اکسیداسیون صفر خواهد بود. در ترکیبات دوتایی، عنصر اول دارای مقدار مثبت است که مربوط به بالاترین ظرفیت است. برای دومی، این پارامتر با تفریق عدد گروه از هشت تعیین می شود و دارای علامت منفی است. فرمول های متشکل از سه عنصر تفاوت های ظریف خاص خود را برای محاسبه حالت های اکسیداسیون دارند.
برای عنصر اول و آخر، ترتیب مشابه تعریف در ترکیبات دوتایی است و معادله ای برای محاسبه عنصر مرکزی ساخته شده است. مجموع همه شاخص ها باید برابر با صفر باشد، بر این اساس، شاخص برای عنصر میانی فرمول محاسبه می شود.
بیایید به ادامه گفتگو در مورد چگونگی یکسان سازی معادلات شیمیایی با استفاده از روش تعادل الکترونی بپردازیم. پس از تنظیم حالت های اکسیداسیون، می توان آن دسته از یون ها یا موادی را که در طی برهمکنش شیمیایی تغییر کرده اند، تعیین کرد.
علائم مثبت و منفی تعداد الکترون هایی را نشان می دهد که در فرآیند برهمکنش شیمیایی پذیرفته شده اند. بین اعداد به دست آمده، کمترین مضرب مشترک را پیدا کنید.
هنگام تقسیم آن به الکترون های دریافتی و داده شده، ضرایب به دست می آید. چگونه یک معادله شیمیایی را متعادل کنیم؟ ارقام به دست آمده در ترازنامه باید در مقابل فرمول های مربوطه قرار گیرد. یک پیش نیاز این است که تعداد هر عنصر را در قسمت چپ و راست بررسی کنید. اگر ضرایب به درستی قرار داده شوند، تعداد آنها باید یکسان باشد.

قانون بقای جرم مواد
با بحث بر سر چگونگی یکسان سازی یک معادله شیمیایی، استفاده از این قانون ضروری است. با توجه به اینکه جرم آن دسته از مواد وارد شده به یک واکنش شیمیایی برابر با جرم محصولات حاصل است، می توان ضرایبی را در مقابل فرمول ها قرار داد. به عنوان مثال، اگر مواد ساده کلسیم و اکسیژن با هم تعامل داشته باشند و پس از اتمام فرآیند، اکسید به دست آید، چگونه یک معادله شیمیایی را برابر کنیم؟
برای مقابله با کار، باید در نظر گرفت که اکسیژن یک مولکول دو اتمی با پیوند غیر قطبی کووالانسی است، بنابراین فرمول آن به شکل زیر نوشته شده است - O2. در سمت راست، هنگام کامپایل اکسید کلسیم (CaO)، ظرفیت های هر عنصر در نظر گرفته می شود.
ابتدا باید میزان اکسیژن را در هر قسمت از معادله بررسی کنید، زیرا متفاوت است. طبق قانون بقای جرم مواد باید جلوی فرمول محصول ضریب 2 گذاشته شود سپس کلسیم بررسی می شود. برای اینکه مساوی شود جلوی ماده اصلی ضریب 2 می گذاریم در نتیجه رکورد به دست می آید:
- 2Ca+O2=2CaO.

تجزیه و تحلیل واکنش به روش تعادل الکترونیکی
چگونه معادلات شیمیایی را برابر کنیم؟ نمونه هایی از RIA به پاسخ به این سوال کمک می کند. فرض کنید لازم است ضرایب را با استفاده از روش تراز الکترونیکی در طرح پیشنهادی قرار دهید:
- CuO + H2 = Cu + H2O.
برای شروع، برای هر یک از عناصر موجود در مواد اولیه و محصولات متقابل، مقادیر حالت های اکسیداسیون را قرار می دهیم. شکل زیر را از معادله بدست می آوریم:
- Cu(+2)O(-2)+H2(0)=Cu(0)+H2(+)O(-2).
شاخص ها برای مس و هیدروژن تغییر کرده اند. بر اساس آنها است که ما تراز الکترونیکی را ترسیم می کنیم:
- Cu(+2)+2e=Cu(0) 1 عامل کاهنده، اکسیداسیون.
- H2(0)-2e=2H(+) 1 عامل اکسید کننده، احیا.
بر اساس ضرایب به دست آمده در تراز الکترونیکی، رکورد زیر را از معادله شیمیایی پیشنهادی بدست می آوریم:
- CuO+H2=Cu+H2O.
بیایید مثال دیگری بزنیم که شامل تعیین ضرایب است:
- H2+O2=H2O.
برای یکسان سازی این طرح بر اساس قانون بقای مواد، لازم است با اکسیژن شروع شود. با توجه به اینکه یک مولکول دو اتمی وارد واکنش شده است، لازم است قبل از فرمول محصول برهمکنش، ضریب 2 قرار گیرد.
- 2H2+O2=2H2O.

نتیجه
بر اساس تراز الکترونیکی، می توانید ضرایب را در هر معادله شیمیایی قرار دهید. به فارغ التحصیلان پایه نهم و یازدهم مؤسسات آموزشی که امتحان شیمی را انتخاب می کنند، در یکی از وظایف آزمون های پایانی، وظایف مشابهی ارائه می شود.
الگوریتم
ترتیب ضرایب در معادلات واکنش های شیمیایی
معلم شیمی MBOU OSOSh №2
ولودچنکو سوتلانا نیکولاونا
Ussuriysk
ترتیب ضرایب در معادلات واکنش های شیمیایی
تعداد اتم های یک عنصر در سمت چپ معادله باید با تعداد اتم های آن عنصر در سمت راست معادله برابر باشد.
وظیفه 1 (برای گروه ها).تعداد اتم های هر عنصر شیمیایی درگیر در واکنش را تعیین کنید.
1- تعداد اتم ها را محاسبه کنید:
آ) هیدروژن: 8NH3، NaOH، 6NaOH، 2NaOH،NzRO4، 2H2SO4، 3H2SO4، 8H2SO4;
6) اکسیژن: C02، 3C02، 2C02، 6CO، H2SO4، 5H2SO4، 4H2S04، HN03.
2. تعداد اتم ها را محاسبه کنید: الف)هیدروژن:
1) NaOH + HCl 2) CH4+H20 3) 2Na+H2
ب) اکسیژن:
1) 2CO + 02 2) CO2 + 2H.O. 3) 4NO2 + 2H2O + O2
الگوریتم ترتیب ضرایب در معادلات واکنش های شیمیایی
A1 + O2 → A12O3اتم A1-1 A1-2
اتم های O-2 O-3
2. از بین عناصر با تعداد اتم های متفاوت در قسمت های چپ و راست طرح، عنصری را انتخاب کنید که تعداد اتم های آن بیشتر باشد.
اتم های O-2 در سمت چپ
اتم های O-3 در سمت راست
3. حداقل مضرب مشترک (LCM) تعداد اتم های این عنصر را در سمت چپ معادله و تعداد اتم های این عنصر را در سمت راست معادله بیابید.
LCM = 6
4. LCM را بر تعداد اتم های این عنصر در سمت چپ معادله تقسیم کنید، ضریب سمت چپ معادله را بدست آورید.
6:2 = 3
Al + 3O 2 → آل 2 در باره 3
5. LCM را بر تعداد اتم های این عنصر در سمت راست معادله تقسیم کنید، ضریب سمت راست معادله را بدست آورید.
6:3 = 2
A1+ O 2 → 2A1 2 O3
6. اگر ضریب مجموعه تعداد اتم های عنصر دیگر را تغییر داد، مراحل 3، 4، 5 را دوباره تکرار کنید.
A1 + 3O 2 → → 2A1 2 در باره 3
A1 -1 اتم A1 - 4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → → 2A1 2 در باره 3
. آزمون اولیه کسب دانش (8-10 دقیقه .).
دو اتم اکسیژن در سمت چپ نمودار و یک اتم در سمت راست وجود دارد. تعداد اتم ها باید با استفاده از ضرایب تراز شوند.
1) 2Mg+O2 → 2MgO
2) CaCO3 + 2HCl → CaCl2 + اچ2 O + CO2
وظیفه 2 ضرایب را در معادلات واکنش های شیمیایی مرتب کنید (توجه داشته باشید که ضریب تعداد اتم های یک عنصر را تغییر می دهد.):
1. Fe 2 O 3 + A ل → آ ل 2 در باره 3 + آهن؛ Mg+N 2 → میلی گرم 3 ن 2 ;
2 ال+س → ال 2 اس 3 ; A1+ با → ال 4 سی 3 ;
3. Al + Cr 2 O 3 → Cr + Al 2 O 3 ; Ca+P → حدود 3 پ 2 ;
4. C + اچ 2 → CH 4 ; حدود + سی → CaS 2 ;
5. Fe+O 2 → Fe 3 O 4 ; Si+Mg → میلی گرم 2 Si;
6/.Na + S → Na 2 S; CaO+ با → CaC 2 + CO;
7. Ca+N 2 → سی آ 3 ن 2 ; Si + Cl 2 → SiCl 4 ;
8 Ag+S → Ag 2 S; اچ 2 + با ل 2 → NS ل
9. ن 2 + O 2 → نه بنابراین 2 + با → بنابراین ;
10.HI → اچ 2 → + 1 2 ; mg+ NS ل → MgCl 2 + اچ 2 ;
11. FeS+ NS 1 → FeCl 2 + اچ 2 S; روی + HCl → ZnCl 2 + اچ 2 ;
12.بر 2 +KI → KBr+I 2 ; Si + HF (ر) → SiF 4 + اچ 2 ;
1./HCl+Na 2 CO 3 → CO 2 +H 2 O + NaCl؛ KClO 3 + اس → → KCl + SO 2 ;
14.کل 2 +KBr → KCl + Br 2 ; SiO 2 + با → Si + CO;
15. SiO 2 + با → SiC+CO; Mg+SiO 2 → میلی گرم 2 Si+MgO
16. میلی گرم 2 سی + HCl → MgCl 2 + SiH 4
1. معادله یک واکنش شیمیایی چیست؟
2. سمت راست معادله چه نوشته شده است؟ و در سمت چپ؟
3. علامت «+» در معادله به چه معناست؟
4. چرا ضرایب را در معادلات شیمیایی قرار دهید